认证服务支持
日期:2024-07-05
作者:霍尔斯HOLVES
|
提供的认证文件 Introduction
|
|
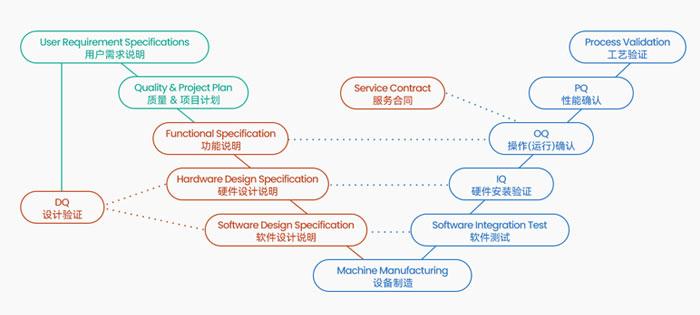
切向流系统(TFF)的认证文件是为了确保系统的安全性和有效性,以及符合药品监管机构的要求,切向流超滤系统需要进行全面的验证。全套GMP(Good Manufacturing Practice)验证文件是制药企业为了证明其生产过程、设备和产品符合GMP标准而准备的一系列文件。这些文件通常包括以下几个方面:
-
1. 设备安装和验收(IQ)文件
-
• 安装确认(Installation Qualification, IQ):验证设备安装是否符合设计要求和制造商的规格。
-
• 验收测试(Acceptance Testing, AT):确保设备在出厂前已经过全面测试,并符合购买方的要求。
-
2. 操作验证(OQ)文件
-
• 操作确认(Operational Qualification, OQ):验证设备在预定操作范围内的性能稳定性和一致性。
-
• 标准操作程序(Standard Operating Procedures, SOPs):详细描述设备的操作步骤、维护、清洁和故障排除等。
-
3. 性能验证(PQ)文件
-
• 性能确认(Performance Qualification, PQ):验证设备在实际生产中的性能,包括过滤效率、产品质量和产量等。
-
• 验证报告:记录验证过程中的所有数据和结果,以证明设备满足生产需求。
-
4. 系统和软件验证文件
-
• 系统验证:确保控制系统、数据记录和报警系统等能够正确运行,并且符合GMP要求。
-
• 软件验证:验证控制软件的功能和安全性,确保数据的完整性和可追溯性。
-
5. 验证主计划和验证总结报告
-
• 验证主计划(Validation Master Plan, VMP):概述整个验证过程的策略、方法和时间表。
-
• 验证总结报告:汇总所有验证活动的结果,提供设备或系统符合GMP标准的最终证据。
-
6. 供应商文件和技术支持
-
• 供应商提供的技术文件:包括设备的设计文件、材质证明、制造商的验证文件等。
-
• 技术支持和培训记录:证明操作人员已经接受过适当的培训,并能够正确操作和维护设备。
准备这些文件需要跨部门的合作,包括质量保证、生产、工程和研发等部门。验证过程需要严格按照预先制定的计划进行,所有数据和结果都需要详细记录和存档,以便在审计和检查时提供。
对于切向流过滤系统通常会提供一定程度的验证支持,包括设备确认文件、操作手册、软件验证文件等。客户还需要根据自己的生产环境和产品特性,进行具体的验证活动,并准备相应的验证文件。
|
以上为霍尔斯HOLVES为用户提供的认证服务支持,想了解更多,可联系我们!
联系我们

